Biologia delle radiazioni (3/5): Basse dosi ed il loro potenziale di danno
Il fatto che la gravità di una malattia aumenti a seguito dell’esposizione a una dose elevata è indiscutibile nella biologia delle radiazioni. Nella radioprotezione quotidiana, tuttavia, è importante essere in grado di stimare il rischio di una mutazione del materiale genetico – e il conseguente rischio di cancro – anche nella gamma delle dosi minori.
Come menzionato nell’articolo precedente di questa serie, a basse dosi di radiazioni sono associati effetti stocastici o casuali. Questo significa che è possibile pronunciarsi sulla probabilità di insorgenza di una malattia solo per un gruppo e non per gli individui. Tuttavia, la biologia delle radiazioni non può valutare se e dove venga causata questa mutazione. Pertanto, non è chiaro se una malattia si verifichi in singoli casi – e in caso affermativo, quale sia il caso individuale.
Una valutazione affidabile del rischio è utile per migliorare la consapevolezza di una radioprotezione prudente. Determinare questo rischio è quindi uno dei compiti centrali dell’epidemiologia insieme alla biologia delle radiazioni.
Come i livelli di dose influenzano il rischio di malattia
La Commissione Internazionale per la Protezione Radiologica (ICRP) ha introdotto un modello che descrive la relazione tra la dose ed il rischio che ne deriva: il modello LNT, denominato anche modello Linear-No-Threshold o «modello lineare senza dose soglia». Secondo il modello LNT, la relazione lineare è attendibilmente adottata per dosi acute a partire da circa 100 millisievert (mSv).
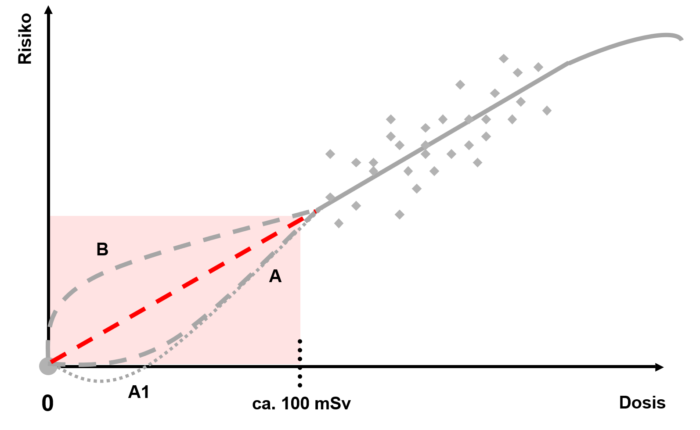
Per quanto riguarda le dosi inferiori a 100 mSv, invece, non è chiaro se esse abbiano un effetto lineare sul rischio di indurre una malattia. Sono stati svolti vari studi epidemiologici a questo riguardo, che giungono a conclusioni diverse. Alcuni riportano un aumento statisticamente rilevante del rischio di cancro tra 0 e 100 mSv, altri studi non rilevano alcuna relazione. Gli organismi internazionali di esperti UNSCEAR (Comitato scientifico delle Nazioni Unite per lo studio degli effetti delle radiazioni ionizzanti) e ICRP (Commissione internazionale per la protezione radiologica) sottopongono ciascuno di questi studi a una revisione critica e formulano raccomandazioni di cui l’IFSN tiene generalmente conto.
Secondo l’ipotesi della linearità senza soglia (LNT) (linea rossa in questo grafico), ogni dose, non importa quanto piccola, comporta un aumento proporzionale del rischio. Nella gamma di dosi molto basse, tuttavia, c’è molta incertezza, poiché il rischio causato in determinate circostanze può essere inferiore al rischio già spontaneamente presente. Il rischio provocato e quello spontaneo sono quindi difficilmente distinguibili l’uno dall’altro. In questo ambito le dichiarazioni sul rischio sono possibili solo utilizzando calcoli e stime statistiche. Le associazioni di esperti UNSCEAR (Comitato scientifico delle Nazioni Unite per lo studio degli effetti delle radiazioni ionizzanti) e ICRP (Commissione internazionale per la protezione radiologica) mettono quindi in guardia contro l’uso del modello LNT per calcolare il rischio di livelli molto bassi delle dosi. Tale modello non è nemmeno adatto a calcolare il numero di casi di cancro prevedibili.
In Svizzera, come ipotesi cautelativa e quindi conservativa, si prende in considerazione il modello LNT (modello lineare senza soglia), presentato nell’Ordinanza sulla radioprotezione totalmente rivista (in vigore dal 2018). L’IFSN utilizza il modello LNT principalmente per valutare le misure di ottimizzazione nella radioprotezione operativa.
Come il corpo reagisce alle basse dosi di radiazioni
In base ai risultati degli esperimenti radiobiologici, si può concludere che le cellule possono gestire molto bene dosi molto basse grazie al loro sistema di riparazione. Questo potrebbe comportare un rischio teorico minore del rischio previsto (curva A nel grafico). Da queste concezioni è stata derivata la teoria dell’effetto biopositivo di dosi molto basse (curva A1). Una dose molto piccola potrebbe innescare il sistema di riparazione delle cellule e quindi proteggerle dai danni incombenti, ma non causare di per sé effetti negativi degni di nota.
Il sistema di riparazione molecolare
Poiché le radiazioni ionizzanti come pure le radiazioni terrestri o i raggi cosmici sono parte integrante della natura, l’umanità è stata sotto la loro influenza per tutta la sua evoluzione. Le cellule umane devono quindi aver trovato un modo per far fronte a una certa quantità di radiazioni. Per riparare i danni delle radiazioni al materiale genetico, le cellule hanno sviluppato un sistema di riparazione molecolare specializzato. Solo quando questo sistema è sovraccarico o non (completamente) funzionante a causa di mutazioni – per esempio nel caso di malattie ereditarie – possono verificarsi mutazioni permanenti nel materiale genetico.
Il sistema di riparazione molecolare delle cellule si è evoluto per essere utilizzato su tutto il nucleo cellulare. Le ionizzazioni, che possono portare a mutazioni, avvengono in modo relativamente concentrato lungo una «traccia di radiazione» anche a dosi basse. In questo modo le molecole di riparazione dovrebbero raggiungere prima i possibili siti danneggiati e posizionarsi lì. Durante questo lasso di tempo, gli effetti delle radiazioni non possono quindi essere eliminati o non completamente (curva B). Il rischio derivante sarebbe quindi maggiore del previsto, almeno inizialmente.
Dal momento che nessuna delle due teorie è stata ancora confermata scientificamente dagli esperimenti, il compromesso è adottare un approccio prudente nella biologia delle radiazioni: esiste una relazione lineare tra la dose e il rischio che ne deriva – anche a basse dosi.
Radiazioni ionizzanti come fattore scatenante di mutazioni cellulari
Che le radiazioni ionizzanti possano contribuire allo sviluppo del cancro è stato riconosciuto scientificamente da molto tempo. I meccanismi genetici che causano le mutazioni cellulari erano invece molto meno conosciuti. Questa situazione è cambiata nel corso degli ultimi decenni.
Attraverso la scoperta e lo studio dei cosiddetti oncogeni (geni tumorali), gli scienziati hanno individuato processi fondamentali attraverso i quali le cellule normali si trasformano in cellule tumorali attraverso vari percorsi. Il confronto tra cellule non irradiate e irradiate mostra quali effetti sono innescati dalle radiazioni ionizzanti.
In Svizzera diverse decine di migliaia di persone sviluppano spontaneamente il cancro ogni anno. I progressi della medicina nelle aree della diagnosi precoce e della terapia hanno aumentato significativamente le possibilità di curare molti tipi di cancro.
Questo è il terzo di cinque articoli dedicati al tema della biologia delle radiazioni. Il quarto articolo si occupa della misurazione delle radiazioni ionizzanti.

