Radiobiologie (3/5) : Doses faibles et leur potentiel d’atteinte à la santé
Le fait que la gravité de la maladie augmente en cas de forte dose ne fait aucun doute en radiobiologie. Pour la radioprotection quotidienne, il est cependant important d’évaluer également les risques de mutations dans le matériel génétique, et donc le risque de cancer, lors de l’exposition à des doses plus faibles.
Comme l’explique l’article précédent de la série, en cas de faible dose d’irradiation, on parle d’effets stochastiques, c’est-à-dire aléatoires. Ce qui signifie que la probabilité d’une maladie ne peut être déterminée que pour un groupe de personnes et non pas pour un individu. La radiobiologie ne peut cependant pas prévoir si et où une mutation risque d’avoir lieu. Il est donc difficile de prédire si une maladie apparaîtra dans un cas particulier et, si oui, laquelle.
Une évaluation fiable des risques est utile pour améliorer la prise de conscience de la radioprotection. La détermination des risques est donc une tâche centrale de l’épidémiologie en collaboration avec la radiobiologie.
Effet des valeurs de dose sur les risques de maladies
La Commission internationale de protection radiologique ICRP a développé un modèle qui représente la relation entre la dose et le risque qui en résulte : le modèle LNT également nommé Linear-No-Threshold-Model ou « modèle linéaire sans seuil ». Selon le modèle LNT, une relation linéaire est considérée comme incontestable pour les doses aigües à partir de 100 millisieverts (mSv) environ.
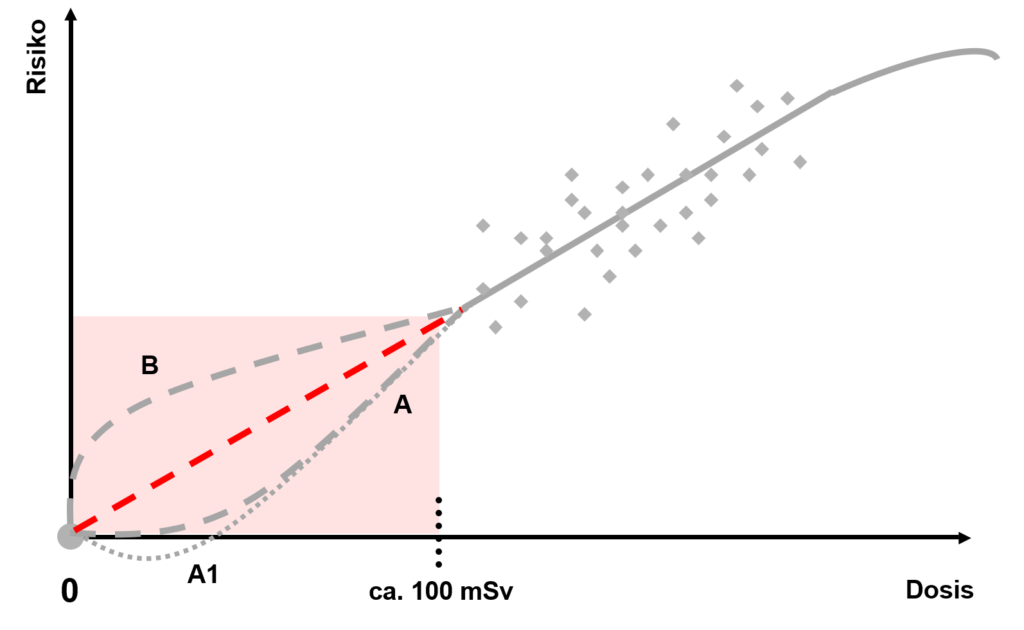
Avec des doses inférieures à 100 mSv, il n’est pas évident que le risque de maladie augmente de manière linéaire. Diverses études épidémiologiques ont été réalisées sur ce thème avec des résultats divergents. Certaines font état d’une augmentation statistiquement significative du risque de cancer entre 0 et 100 mSv, alors que d’autres ne voient aucun lien. Les comités scientifiques internationaux UNSCEAR et ICRP soumettent ces études à un examen critique et formulent des recommandations dont l’IFSN tient compte.
Selon l’hypothèse LNT (ligne rouge sur le graphique), chaque dose, aussi petite soit-elle, entraîne une augmentation proportionnelle du risque. Dans le domaine des très faibles doses, il subsiste cependant une très grande incertitude car, selon les circonstances, le risque induit est plus petit que le risque déjà présent spontanément. Il est donc difficile de distinguer les risques induits des risques spontanés. Dans ce domaine, le risque ne peut être évalué que par des calculs et des estimations statistiques. Les comités scientifiques UNSCEAR et ICRP mettent donc en garde contre l’utilisation du modèle LNT pour calculer les risques de doses très faibles. Ils considèrent que le modèle ne convient pas non plus pour calculer le nombre de cas de cancers attendus.
En Suisse, dans la révision totale de l’ Ordonnance sur la radioprotection (en vigueur depuis 2018), le modèle LNT est pris en compte en tant qu’hypothèse prudente et donc conservatrice. L’IFSN utilise essentiellement le modèle LNT pour évaluer les mesures d’optimisation dans la radioprotection opérationnelle.
Comment le corps réagit à de faibles doses d’irradiation
Les résultats d’expérimentations radiobiologiques permettent de conclure que, grâce à leur système de réparation, les cellules réagissent très bien à de très faibles doses. Cela amènerait à un risque théorique inférieur au risque attendu (courbe A dans le graphique). Il en résulte la théorie des effets biopositifs de très petites doses (courbe A1). En effet, une très faible dose pourrait stimuler les mécanismes de réparation cellulaires protégeant ainsi la cellule des futurs dommages qui pourraient la toucher, tout en ne provoquant aucun effet négatif notable.
Les mécanismes de réparation moléculaires
Comme les rayonnements ionisants font partie intégrante de la nature, qu’il s’agisse de rayonnements cosmiques ou émis par le sol, l’humanité s’est trouvée sous leur influence tout au long de son développement. Les cellules humaines ont donc dû trouver un moyen de vivre avec un certain degréd’irradiation. Pour réparer les dommages du matériel génétique dus aux rayonnements, les cellules ont développé un système de réparation moléculaire spécialisé. Des mutations permanentes du matériel génétique ne peuvent survenir que si ce système est saturé ou s’il n’est pas (entièrement) fonctionnel en raison d’une mutation (par exemple consécutive à une maladie héréditaire).
Le système de réparation moléculaire des cellules s’est développé pour agir dans tout le noyau cellulaire. Même à faible dose, des ionisations susceptibles de causer des mutations ont lieu de manière relativement concentrée le long d’une « piste de rayonnement ». Les molécules réparatrices devraient donc d’abord parvenir aux lieux de détérioration potentiels et s’y positionner. Pendant ce temps, les effets des rayonnements ne peuvent pas ou pas complètement être réparés (courbe B). Le risque qui en résulte serait donc plus élevé qu’attendu, au moins au début.
Comme aucune des deux théories n’a pu être prouvée par des expériences scientifiques, l’hypothèse prudente suivante est admise comme compromis en radiobiologie : il existe une relation linéaire entre la dose et le risque qui en découle, même à faible dose.
Rayonnements ionisants comme déclencheurs de mutations cellulaires
Le fait que les rayonnements ionisants peuvent contribuer au développement d’un cancer est admis depuis longtemps par le monde scientifique. Ce qui était par contre moins connu, ce sont les mécanismes génétiques qui entraînent ces mutations cellulaires. Ceci a changé au cours de ces dernières années et décennies.
Par la découverte et l’analyse des oncogènes (gènes du cancer), les scientifiques ont découvert des processus de base qui permettent de transformer des cellules normales en cellules cancéreuses de diverses manières. La comparaison entre cellules irradiées et non irradiées démontre les effets des rayonnements ionisants.
Spontanément, plusieurs milliers de personnes sont touchées par le cancer chaque année en Suisse. Les progrès de la médecine en matière de détection précoce et de thérapie ont permis d’augmenter de manière significative les chances de guérison pour de nombreux types de cancers.
Ceci est le troisième de cinq articles traitant de la radiobiologie. La quatrième partie se penche sur la mesure des rayonnements ionisants.

